導入:塊根・多肉を「綺麗に大きく」育てる鍵は、水と空気のバランスです 💧🌬️
塊根植物や多肉植物を鉢で美しく育てるとき、最初に直面する壁は「どれだけ水を持たせ、どれくらいの速さで乾かすべきか」という問いです。水を多く含ませれば安心に見えますが、長く湿ったままだと根が呼吸できず、見えないところで弱っていきます。逆に乾かしすぎれば、せっかくの生長が止まります。本記事では、用土の水の持ち方を示す水保持曲線(WRC:用土が保持できる水分量と吸い上げに要る力の関係)と、鉢という容器ならではの水のたまり方(容器ハイドロロジー)に基づいて、「保水性」と「乾き時間」の最適点を探ります。
1. 水保持曲線(WRC)とpFという“ものさし”を整える📏
1-1. 水保持曲線とは何か
水保持曲線(WRC)とは、用土がどれだけ水を含み、どれだけの力で水を引き留めているかを示す「性格表」です。乾いたスポンジと緻密なスポンジで水の抜け方が違うように、粗い資材主体の用土は水がすぐ抜け、細かい資材主体の用土はしぶとく水を抱えます(Bunt, 1988)。水保持曲線(WRC)のグラフを見ると、左端は「水を入れすぎて鉢の土がびしょびしょになった直後の状態」を示します。このときは土の隙間がすべて水で埋まっていて、これを飽和含水率と呼びます。逆に右端は「完全に乾ききっても、どうしても細かい粒の表面に残って離れない水」が残っている状態です。これは植物が吸えない水なので残留含水率と呼びます(Milks et al., 1989)。
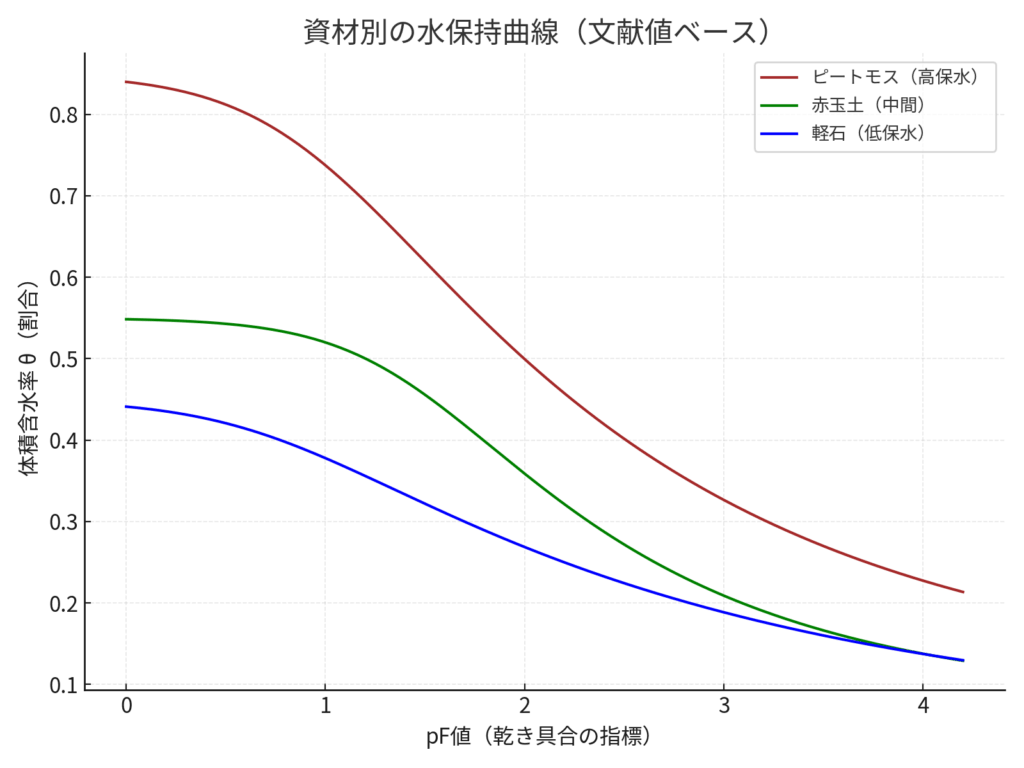
資材別の水保持曲線(文献値ベース)
グラフは、pF値(横軸)が大きいほど乾燥が進むことを示し、縦軸は体積含水率を表します。茶色のピートモスは水を非常に多く保持し乾きにくく、緑色の赤玉土は中間的な性質を持ち、青色の軽石は水がすぐ抜けて乾きやすい傾向を示しています。資材ごとの違いが、鉢植え管理の潅水頻度や乾き時間に直結します。
1-2. pFは「乾き具合」を表す便利な目盛り
pFは「どれだけの吸い上げ力で水が保持されているか」を表す簡便な目盛りです。数字が大きいほど乾いていると考えてください。目安としてpF2は「軽く乾いた」、pF3は「かなり乾いた」領域に近い理解で実用上差し支えありません(Bunt, 1988)。
1-3. 鉢ならではの現象:容器容量と保水層🌟
鉢に水を与えると、余分な水は底穴から抜けますが、すぐには全て抜けきらず、底側に水がたまりやすくなります。これを保水層(鉢底の水のたまり)と呼び、浅い鉢ほど相対的に厚くなります。自由排水後に用土が保持する水分量を容器容量と呼びます(Bilderback & Fonteno, 1987)。同じ配合でも「深鉢=通気しやすく乾きやすい」「浅鉢=湿りやすい」という性質が生まれます。これは直感に反して聞こえるかもしれません。確かに深鉢のほうが土の量は多いので全体としては水を多く含みますが、鉢の底にできる保水層(毛管作用で常に水がたまる層)の厚みは、鉢の深さにほとんど関係なく一定です。そのため、浅鉢では土全体の高さに対してこの保水層が占める割合が大きくなり、鉢全体が“湿りがち”になります。一方、深鉢では同じ厚みの保水層が全体の中で占める割合が小さく、残りの部分は空気が入りやすいため通気性が高まり、結果として乾きやすく感じられるのです(Bilderback & Fonteno, 1987)。
2. 通気の指標:空気相率(AFP)と根の呼吸🫁
2-1. 空気相率は「根が吸える酸素の目安」
空気相率(AFP)は、用土の全ての隙間のうち空気が占める割合です。潅水直後でもAFPが確保できていれば、根はしっかり酸素を受け取れます。温室園芸の古典的知見では、作物により差はあっても潅水直後でAFP20%以上が望ましいという目安があります(de Boodt & Verdonck, 1972)。AFPが10%程度まで落ちると酸素拡散が急に不足して根のはたらきが鈍くなります(Letey, 1961)。
2-2. 「乾き時間」はAFPとセットで考える🌟
潅水直後は多少湿り気が高くても、数時間~数日でAFPが回復するなら安全域に戻ります。逆に、何日もAFPが低いままだと、見た目が元気でも根はダメージを蓄積します。ゆえに、最適点とは潅水直後にAFPが20%以上確保され、その後「下限の乾き」まで適切な日数で到達する状態と定義できます(de Boodt & Verdonck, 1972; Bilderback & Fonteno, 1987)。
3. 塊根・多肉の生理:水より「空気」を優先する理由🍃
3-1. CAM型の呼吸リズムと貯水組織
多肉・塊根の多くはCAMという省エネ型の光合成を採用し、夜に気孔を開いて二酸化炭素を取り込み、昼は気孔を閉じ気味にして水のムダを抑えます(Osmond, 1978)。さらに茎や根に貯水組織を持つため、一時的な乾きに耐える力が強い特徴があります(Nobel, 1988)。つまり、「やや乾き気味+高い通気性」の環境でこそ本領を発揮します。
3-2. 過湿のメカニズム:酸欠→弱体化→病害
用土が長く湿りすぎると、根は酸欠になって活動が鈍り、傷つきやすくなります。そこへ水の多い環境を好む病原体(PythiumやPhytophthoraなど)が攻め込むと、いわゆる根腐れが起きます(Stanghellini & Rasmussen, 1994)。この連鎖を断つ最も確実な方法は、「潅水直後でも通気を確保し、湿りっぱなしの時間を短くする」ことです。
4. 微生物と病害の視点:“ちょうど良い湿り”を狙う😊
4-1. 適度な湿りは微生物を元気にする
土の中の隙間は、水で満たされている部分と空気が通る部分があります。この割合が微生物の活動に大きく関わります。研究によれば、隙間のおよそ6割が水で満たされている状態で、土壌中の呼吸や分解の働きが最も盛んになります(Linn & Doran, 1984)。これより水が少なすぎても多すぎても働きは落ちてしまいます。つまり土がしっとりしていて、同時に空気の通り道も残っている状態が、根にも微生物にも一番心地よい環境なのです。
4-2. 水が多すぎると病原菌のリスクが高まる
逆に、水が隙間に行き渡りすぎて空気がほとんど入らない状態では、病原菌が勢いを増します。特にピシウムなどの卵菌は、水の膜を泳ぐようにして根にたどり着き、感染を広げます(Stanghellini & Rasmussen, 1994)。土の中が過度に湿った状態で保たれるほど、このリスクは高まります。ですから、潅水直後でも土全体がべたついたままにならず、できるだけ早く空気が通る状態に戻るようにすることが大切です。目安としては、与えた水が抜けてから土の隙間に残る水の割合を8割以下に抑えると安全とされています(Linn & Doran, 1984)。
5. “数値の目安”を実務に落とす:指標対応表と乾き時間
5-1. まずは「上限」と「下限」を決める
管理しやすいよう、潅水直後の「上限」と次の潅水タイミングの「下限」を指標で決めます。多肉・塊根を想定した代表的な目安は次のとおりです。あくまで目安であり、鉢の深さや粒径分布、環境で変わる点に注意します。
| 指標 | 潅水直後(上限目安) | 次の潅水(下限目安) | 根拠の例 |
|---|---|---|---|
| pF(乾きの度合い) | pF 0~2相当 | pF 2.7~3.0相当 | Bunt (1988) |
| AFP(空気の割合) | ≥20% | 増えていくこと(高いほど通気的) | de Boodt & Verdonck (1972), Letey (1961) |
| WFPS(水の割合)※ | ≤80%程度 | 50~60%帯を中心 | Linn & Doran (1984) |
この帯に収めると、「過湿の危険を避けつつ、夜間に根が吸える水は残す」という塊根・多肉に合った運用になります。
※WFPS = Water-Filled Pore Space。土の隙間における水と空気のバランスを数値化したもの。
5-2. 乾き時間は季節・場所・鉢で変わる
「潅水直後→下限」までの所要日数(乾き時間)は、気温、湿度、日射、風、鉢材質で大きく変わります。蒸発散の見積もりに使われるFAOの計算法(Penman–Monteith)では、夏の屋外は日あたりの水消費が大きい一方、冬の室内は極端に小さいという傾向が明確です(Allen et al., 1998)。素焼き鉢は側面からも水が抜けて乾きやすく、プラ鉢は乾きにくい特性があります。浅鉢は保水層が相対的に厚くなって湿りやすく、深鉢は通気的です(Bilderback & Fonteno, 1987)。
| 条件 | 下限までの代表的な目安 |
|---|---|
| 夏・屋外(直射・風通しあり) | 2~5日 |
| 夏・室内(エアコン・送風あり) | 4~7日 |
| 冬・屋外(無加温) | 7~14日 |
| 冬・室内(低日照・無風) | 10~21日 |
これらは鉢サイズや用土で前後します。自分の環境での“標準値”を、鉢の重さを量る重量法で把握しておくと正確です(Milks et al., 1989)。
6. 配合で最適点を作る:PHI BLENDの位置づけ🌟
6-1. 配合の狙いと物性のイメージ
本ブログの基準配合であるPHI BLENDは、無機質75%(日向土・パーライト・ゼオライト)+有機質25%(ココチップ・ココピート)で構成され、粒径は中粒中心です。狙いは潅水直後でもAFPを確保しつつ、夜間に根が吸える分の水を残すというバランスです。園芸用培地の水分特性は、材料ごとの曲線を組み合わせておおまかに予測できます(Milks et al., 1989; Fields et al., 2014)。中粒主体で微粉が少ないほど「抜けが良く」「再湿潤性はやや落ちやすい」傾向が出ます。ココピートは再湿潤を助け、ゼオライトは保肥性の底上げを担います(Puustjärvi & Robertson, 1975)。
6-2. 浅鉢・深鉢と季節で微調整する
浅鉢で湿りがちな環境では、やや粗めの粒度を選び、パーライト比率を少し上げるとAFPが稼げます。冬の室内で乾きにくい場合は、粒度を上げるか、素焼き鉢に変えるのも有効です。反対に夏の屋外で乾きが速すぎる場合は、ココピートやゼオライトの比率を少し上げ、微粉の発生を抑えつつ水持ちを補います。ただしAFPが20%を割り込む調整は避けることが基本です(de Boodt & Verdonck, 1972)。
7. 代表的な属ごとの勘所:アガベ/パキポディウム/ユーフォルビア🪴
7-1. アガベ(夏型・乾き好き)
アガベは根が酸素を好み、蒸れを嫌います。潅水直後でもAFPを高めに取り、乾き時間は夏で2~4日程度が扱いやすい範囲です。日射が強いほど蒸散は増えますが、根が酸欠だと地上部の充実が鈍ります(Nobel, 1988)。
7-2. パキポディウム(塊根巨大・細根は繊細)
パキポディウムは塊根に水分を蓄えますが、細い吸収根は長時間の過湿に弱いです。植え替え後は潅水を控えめにし、根が伸び始めてから通常管理に移します。乾き時間の目安は夏で3~5日、夜間にうっすら湿りを残すと動きが安定します(Osmond, 1978)。
7-3. ユーフォルビア(種類多様・寒湿に弱い種が多い)
ユーフォルビアは種類が多く一概に言えませんが、総じて低温期の湿りっぱなしに弱い傾向があります。冬は乾かし気味+明るい場所で、下限pFを高めに(= よく乾かす方向)取ると安全です(Stanghellini & Rasmussen, 1994)。
8. 計測と運用:勘に「数字の裏付け」を足す⚖️
8-1. 重量法で“自分の鉢”の乾き時間を知る
潅水直後の鉢の重さを基準とし、毎日同時刻に量ってグラフにします。下限の重さ(次の潅水時点)を決めてしまえば、乾き時間が自分の環境の値として確定します。鉢・用土・季節の影響がまとめて数字に表れるため、再現性の高い方法です(Milks et al., 1989)。
8-2. センサーは補助、最後は目と手で確かめる
テンシオメータや電気式水分計で“乾き具合”を相対的に追うのは便利です。ただし小型鉢ではばらつきも出ます。表土の色、手触り、葉の張り、鉢の重さを総合して判断し、センサー値は補助に徹します(Bunt, 1988)。
9. よくあるつまずきと解決:再湿潤性・腰水・塩のたまり😯
9-1. 乾ききると水を弾く(撥水)
乾燥後に水がしみ込みにくいときは、底面給水でゆっくり湿らせるか、何回かに分けて与えます。ココピートは再湿潤を助けますが、パーライトやバークは乾くと水を弾きやすい癖があります(Puustjärvi & Robertson, 1975; Fields et al., 2014)。
9-2. 腰水は便利だが“やりっぱなし”は禁物
苗の初期活着には腰水が便利ですが、長時間続けると保水層が膨らみ、酸欠や塩分の偏在を招きます。週に一度は上からたっぷり潅水して、余剰の肥料分を洗い流すと安全です(Stanghellini & Rasmussen, 1994)。
10. まとめ:最適点は「潅水直後の通気」と「下限までの時間」で決まる🚿
塊根・多肉の鉢栽培では、潅水直後でもAFP20%以上を確保し、数日で“ちょうど良い湿り”に落ち着く流れを作ることが、見た目の美しさとサイズの両立につながります。夏・屋外なら2~5日、冬・室内なら10~21日を目安に、鉢と配合で微調整すると管理が安定します(de Boodt & Verdonck, 1972; Allen et al., 1998; Bilderback & Fonteno, 1987)。そのための配合として、無機主体で通気の柱を立てつつ、夜の吸水を支える適度な保水をもたせるアプローチは合理的です。
本サイトの基準配合PHI BLENDは、そうしたバランスづくりを出発点に設計しています。詳しい配合とねらいは、以下の製品ページをご覧ください。
塊根植物・多肉植物の用土全般に関するサマリーは以下をご覧ください。
参考文献
Allen, R. G., Pereira, L. S., Raes, D., & Smith, M. (1998). Crop evapotranspiration—Guidelines for computing crop water requirements. FAO Irrigation and Drainage Paper 56.
Bilderback, T. E., & Fonteno, W. C. (1987). Effects of container geometry and media physical properties on air and water volumes in containers. Journal of Environmental Horticulture, 5(4), 180–182.
Bunt, A. C. (1988). Media and Mixes for Container-Grown Plants (2nd ed.). Unwin Hyman.
de Boodt, M., & Verdonck, O. (1972). The physical properties of the substrates in horticulture. Acta Horticulturae, 26, 37–44.
Fields, J. S., Fonteno, W. C., Jackson, B. E., et al. (2014). Hydrophysical properties, moisture retention, and drainage profiles of wood and traditional components for greenhouse substrates. HortScience, 49(6), 827–832.
Letey, J. (1961). Aeration, compaction and drainage. In W. H. Pierre et al. (Eds.), Soil and Fertilizer Phosphorus in Crop Nutrition(関連するODR研究として広く引用).
Linn, D. M., & Doran, J. W. (1984). Effect of water-filled pore space on carbon dioxide and nitrous oxide production in tilled and nontilled soils. Soil Science Society of America Journal, 48(6), 1267–1272.
Milks, R. R., Fonteno, W. C., & Larson, R. A. (1989). Hydrology of horticultural substrates: I. Mathematical models for moisture characteristics of horticultural container media. Journal of the American Society for Horticultural Science, 114(1), 48–52.
Nobel, P. S. (1988). Environmental Biology of Agaves and Cacti. Cambridge University Press.
Osmond, C. B. (1978). Crassulacean acid metabolism: A curiosity in context. Annual Review of Plant Physiology, 29, 379–414.
Puustjärvi, V., & Robertson, R. A. (1975). Physical and chemical properties of peat. Proceedings of the International Peat Society Symposium, 150–181.
Stanghellini, M. E., & Rasmussen, S. L. (1994). Hydroponics: A solution for zoosporic pathogens. Plant Disease, 78(12), 1129–1138.
